本研究室では,新規な立体異性分子を考案し,これらの高選択的合成や構造特性,さらには合成化学的な利用に関する研究を行なっています.以下にその概略を示します.
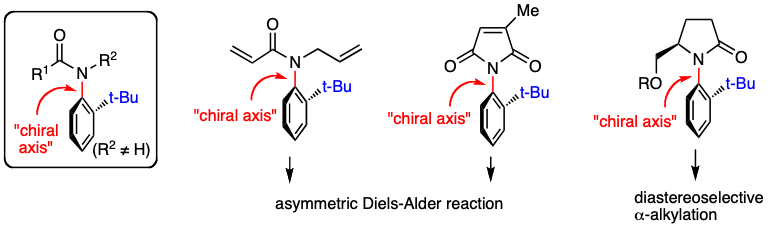
1,光学活性炭素-窒素軸不斉化合物の合成と不斉反応への応用
BINOLやBINAPに代表されるビアリール型アトロプ異性化合物は,不斉反応において最も汎用されている有用なキラル分子の一つである.一方,非ビアリール型アトロプ異性化合物は合成反応へ応用されることもなく,最近まであまり注目されていなかった.私共は,1997年頃より非ビアリール型のアトロプ異性分子として炭素-窒素軸不斉化合物に着目し,研究を行なってきた.そして,キラルプールからの変換ならびに光学分割を利用することにより,光学活性な炭素-窒素軸不斉オルトtert-ブチルアニリド,イミド,ラクタム等の合成に成功した. さらに,このようにして合成した炭素-窒素軸不斉化合物を用いる不斉反応を開発し,キラル分子としての有用性も明らかとした.
さらに,炭素-窒素(C–N)軸不斉化合物の触媒的不斉合成についても成功しており,以下はその代表例である.アキラルなオルト-tert-ブチル-NH-アニリドとp-ヨードニトロベンゼンの反応を(R)-DTBM-SEGPHOS-Pd(OAc)2触媒存在下行なうと,高エナンチオ選択的(88-96%ee)に軸不斉アニリドが得られることを見いだした.本反応は,N-C軸不斉化合物の最初の実用的触媒的不斉合成法を提供するものであり,また,Buchwald-Hartwigアミノ化反応の最初の不斉触媒化として位置付けられる.

また,本不斉触媒反応を分子内反応に適用すると,軸不斉ラクタムが高エナンチオ選択的(93%ee)に得られることも見いだしている.また,得られた軸不斉ラクタムを利用した立体選択的なα-アルキル化反応,ならびにα-アルキル化生成物を用いたノルエピネフリントランスポーター阻害剤の合成にも成功した.

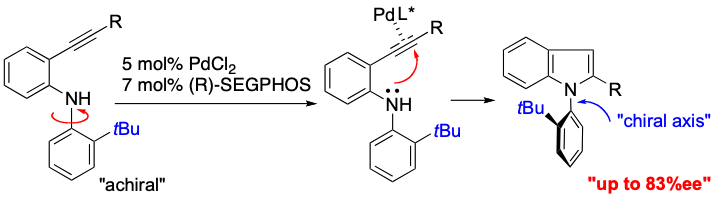
非アミド型の新規C–N軸不斉化合物としてアトロプ異性インドールを考案し,その触媒的不斉合成にも成功している.すなわち,アキラルなオルトアルキニルアニリンの5-endo-ヒドロアミノ環化反応を(R)-SEGPHOS-PdCl2触媒存在下行なうと,軸不斉N-(2-tert-butylphenyl)indole誘導体が最大83%eeで得られることを見いだした.
なお,上記反応がきかっけとなって,その後C–N軸不斉化合物が不斉触媒反応の新たな標的分子として認識されるようになり,現在までに数多くのグループにより種々のN-C軸不斉化合物の触媒的不斉合成が報告されている(これまで260報以上の関連原著論文が報告されている).
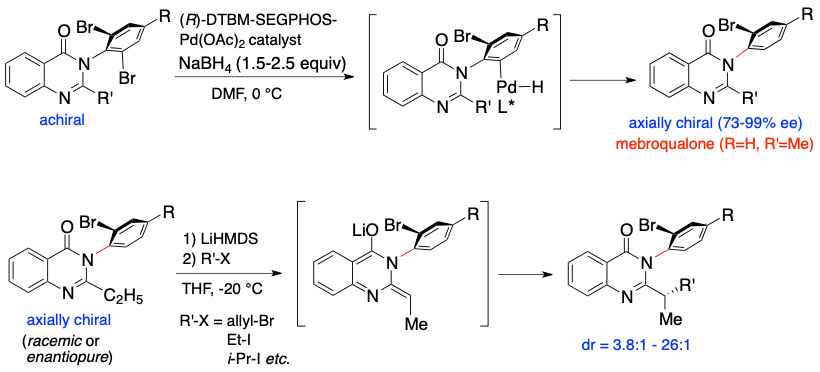
C–N軸不斉化合物の中には生理活性を有するものも知られており,GABA受容体アゴニスト活性を有する軸不斉キナゾリノン誘導体がその代表例である.我々は,生理活性軸不斉キナゾリノン誘導体の触媒的不斉合成にも初めて成功している.すなわち,3位窒素原子上に2,6-ジブロモフェニル基を有するアキラルなキナゾリン-4-オン誘導体に対し,不斉Pd触媒と水素化ホウ素ナトリウムを用いて脱モノブロモヒドロ化(還元的不斉非対称化)を行なうと,光学活性軸不斉メブロカロン誘導体が良好なエナンチオ選択性(73-99% ee)で得られることを見いだした.また,軸不斉メブロカロン誘導体から調製したエノラートにハロゲン化アルキルを加えると,軸不斉部位による立体制御により不斉炭素原子をジアステレオ選択的に構築できることを明らかにした.
その他以下に示したC–N軸不斉化合物の触媒的不斉合成ならびに不斉反応への応用にも成功している.

なお,上述の研究成果(C–N軸不斉化合物の触媒的不斉合成と不斉反応への応用)については,米国化学会発行のAccounts of Chemical Research誌(2021,54, 719-730)にて公表されている.
2,炭素-窒素軸不斉化合物の構造特性に関する研究と分子ローターならびに
同位体アトロプ異性化合物への展開
炭素-窒素軸不斉化合物に関する研究の途上,いくつかの興味深い構造特性を見いだした.例えば,軸不斉3,4-ジヒドロキノリン-2-オンをキノリン-2-オン(不飽和ラクタム)に変換したところ,回転障壁が劇的に(10 kcal/mol程度)向上した.また,軸不斉3,4-ジヒドロキノリン-2-オンより合成した軸不斉テトラヒドロキノリン(軸不斉環状アミン)にメタンスルホン酸を加えると,プロトン化アミンが生成し,回転障壁が大きく低下する(不斉軸の回転速度が大きく向上する)ことを見いだした(プロトングリース現象).
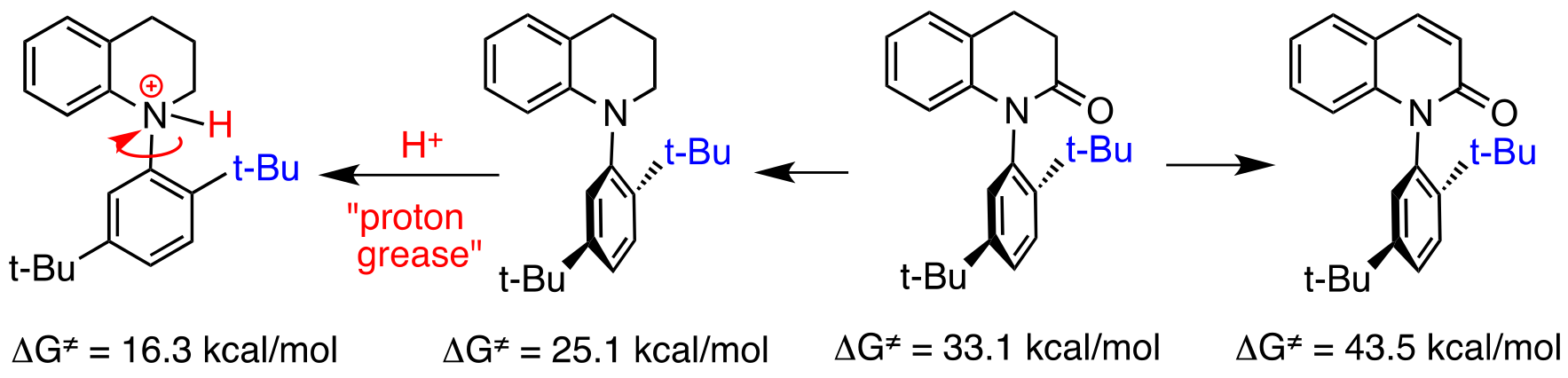
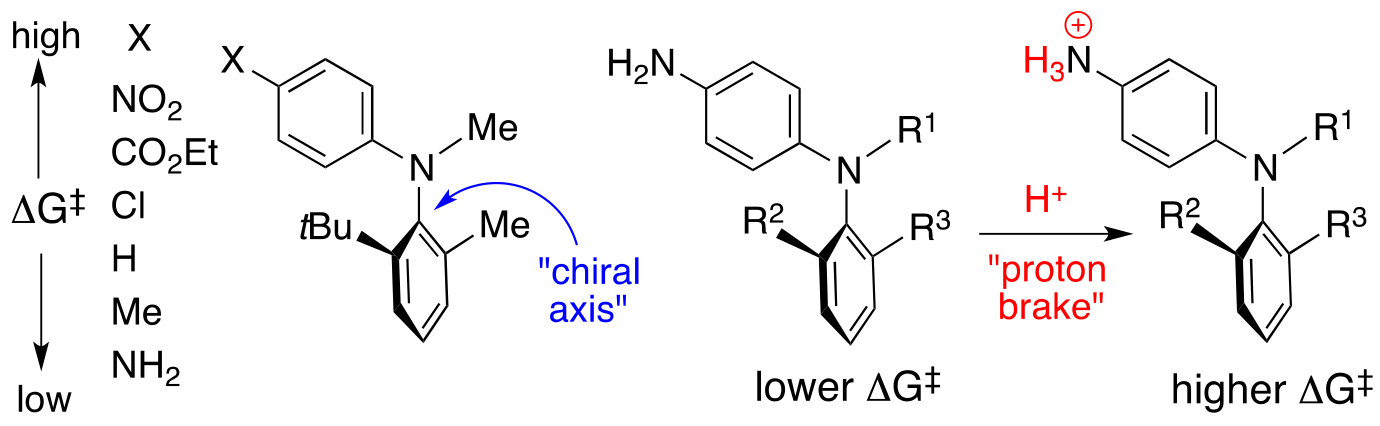
また,軸不斉N-aryl-2-tert-ブチル-6-メチルアニリン誘導体における電子効果と回転障壁の興味深い関係を明らかにした.すなわち,当該アニリンの不斉軸の回転障壁がアリール基上のパラ置換基によって大きな影響を受け,パラ置換基の電子吸引性が増加するほど回転障壁も向上することを見いだした.さらに,この構造特性を基に,プロトン酸を添加することにより不斉軸の回転障壁が向上(回転速度が低下)する分子を見いだし,これをプロトンブレーキと命名した.
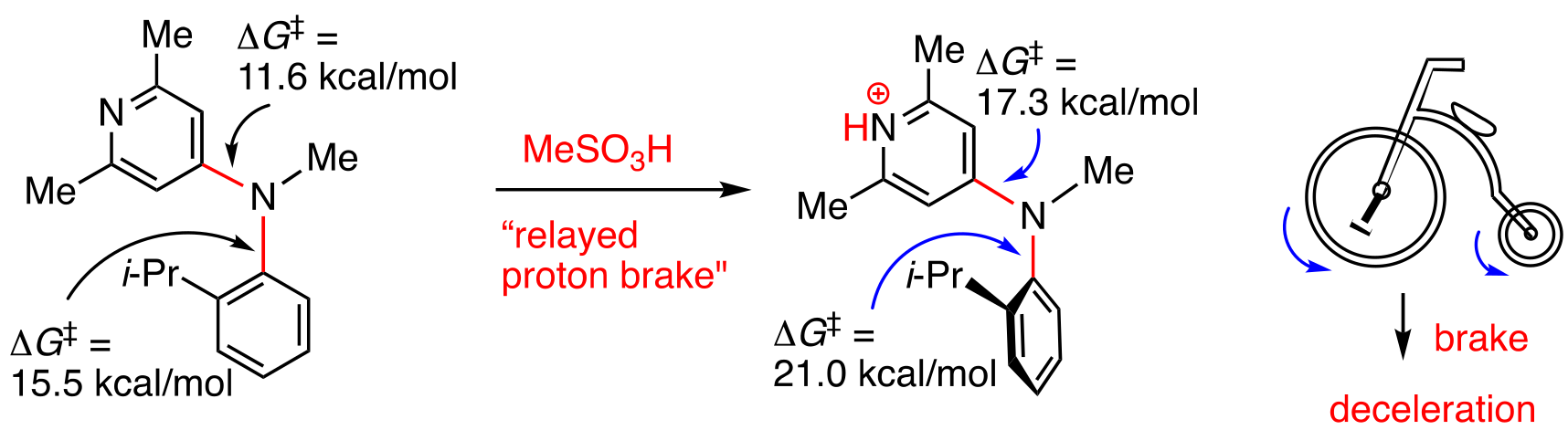
このプロトンブレーキをさらにリレー型プロトンブレーキに展開した.すなわち,N-ピリジル基を有するオルト-イソプロピルアニリンに対しプロトン酸を添加すると,二つのN-Ar結合の回転が連動して減速すること(リレー型プロトンブレーキ)を見い出した.このブレーキシステムは,二輪車のブレーキ(前輪もしくは後輪のブレーキで両輪の回転が減速される)を分子レベルで実現したものと見なすことができる.
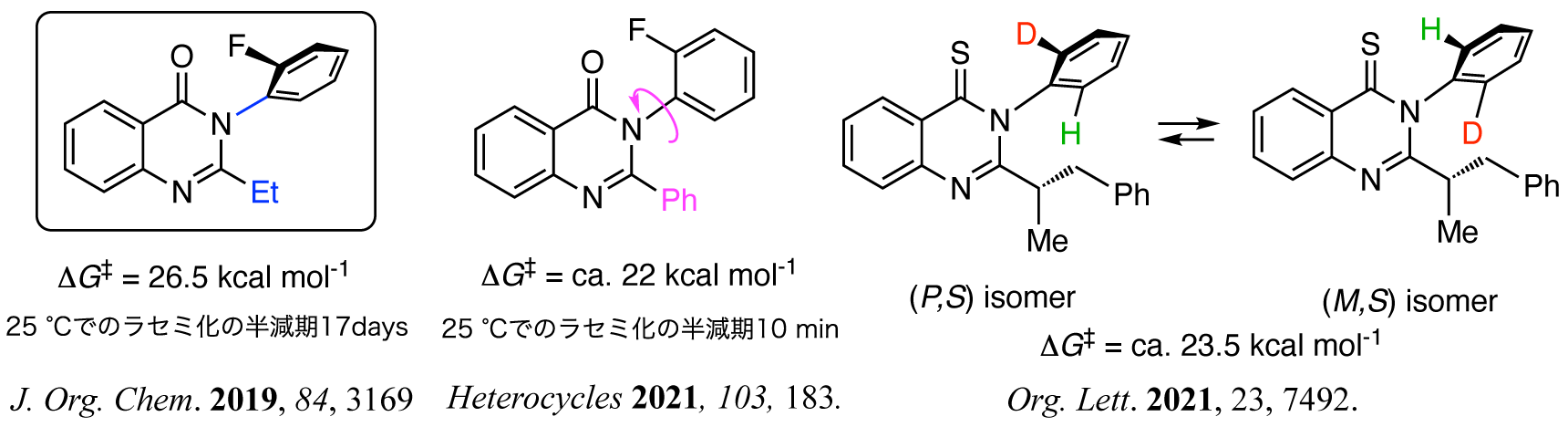
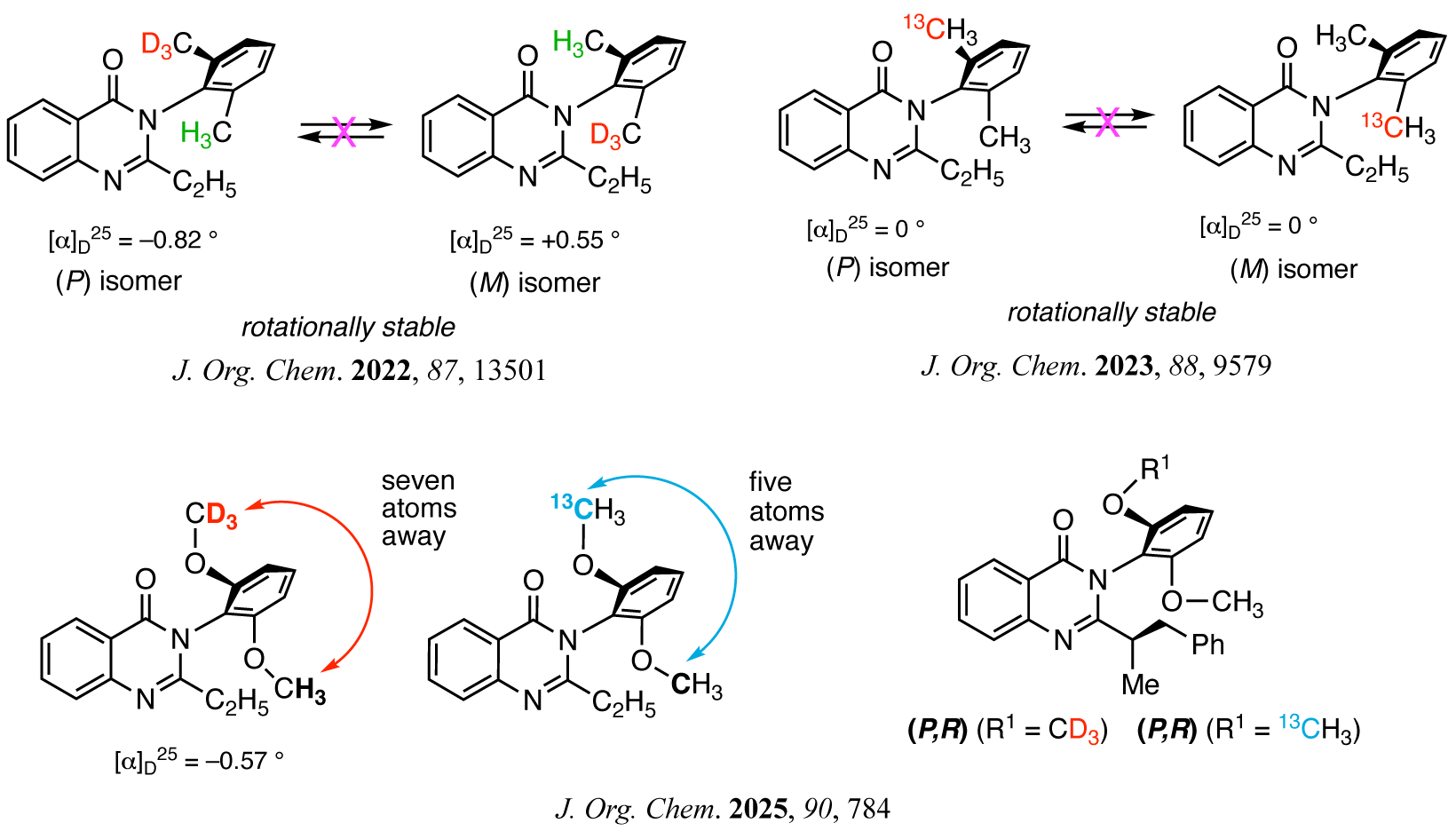
また,軸不斉キナゾリノンの研究の途上,オルト-フルオロフェニル基を有するキナゾリン-4-オンが安定なC–N軸不斉構造を有することを見い出した.このようなオルト位に極小置換基(水素原子とフッ素原子)を有するアトロプ異性型軸不斉化合物は,これまで一般的ではなく興味深い.さらに,この研究からヒントを得て,オルト位軽水素-重水素識別に基づく(さらに小さいオルト位置換基を有する)同位体アトロプ異性の検出に成功した.本研究は,同位体アトロプ異性を直接検出した初めての例である.ただし,本同位体アトロプ異性分子は不安定であり(常温で容易にエピ化する), 単離することができなかった.
常温でも安定な同位体アトロプ異性分子として,3位フェニル基上にオルト-CH3/CD3および12CH3/13CH3基を有する3-アリールキナゾリノン誘導体の創製に成功した.さらに,より遠隔位のH/Dならびに12C/13C識別に基づく同位体アトロプ異性分子として,オルト-CH3O/CD3Oおよび12CH3O/13CH3O基を有する3-アリールキナゾリノン誘導体を合成した.オルト-CH3/CD3体では,微小ながら旋光性が確認されている.また,これら同位体アトロプ異性キナゾリノン誘導体の高い立体化学的純度や回転安定性は,不斉炭素原子を導入したジアステレオマーに変換することによって検証した.
3,アキラルな中圧クロマトグラフィーで観察されたエナンチオマーの自己不均化
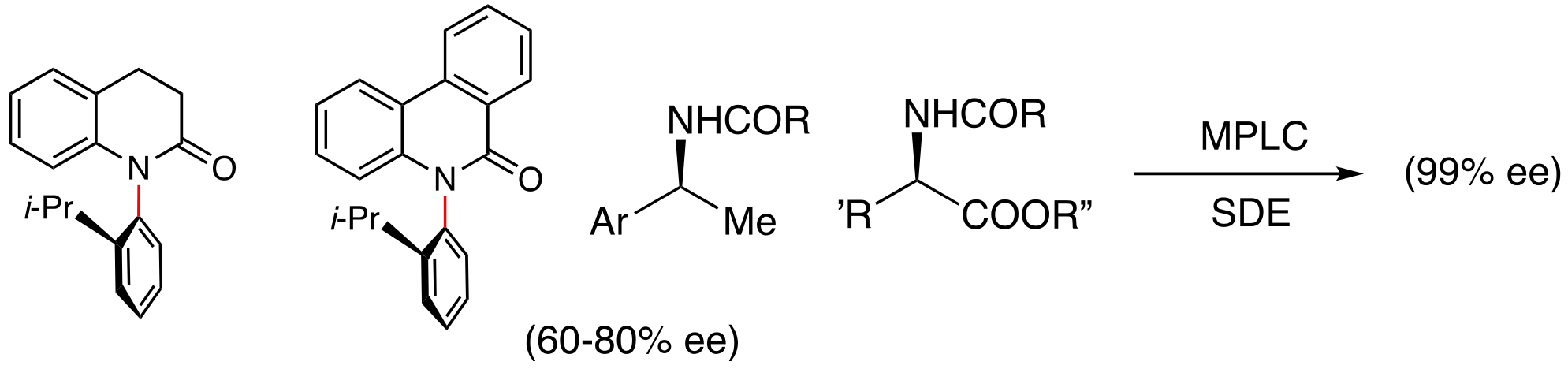
上述した非ラセッミクなN-C軸不斉化合物をアキラルなシリカゲルカラムを用いる中圧液体クロマト(MPLC)により精製したところ,留分ごとに光学純度が大きく異なること,すなわち,エナンチオマーの自己不均化(Self-disproportionation of Enantiomers = SDE)が生じることを見い出した.例えば,68% eeのメブロカロンのMPLCチャートには明確なショルダーが認められ,ショルダーを基準とした前半部の留分には光学的に純粋なメブロカロンが含まれていた.一方で,後半部の留分に含まれているメブロカロンの光学純度は大きく低下している.なお,SDEはホモキラルならびにヘテロキラル会合に起因することが知られているが,メブロカロンにおいては,オルト-ブロモ基とカルボニル酸素との分子間ハロゲン結合による会合が関与していることが示唆されている

このようなMPLCによるSDEは種々のN-C軸不斉化合物に加え,不斉炭素原子を有する非ラセミック化合物でも観察されており,いずれも光学的に純粋な化合物が得られている.SDEを利用して光学的に純粋な化合物が得られた例を以下に示す
上述の結果は,新しいエナンチオマー精製法を提供するという点に加え,不斉反応後のクロマトグラフィーによる精製の際には,全ての生成物を回収してeeを測定しなければ,エナンチオ選択性の評価が不正確になることを示している.
4,常温でも安定なアミド配座異性体の化学:立体選択的合成とその構造特性
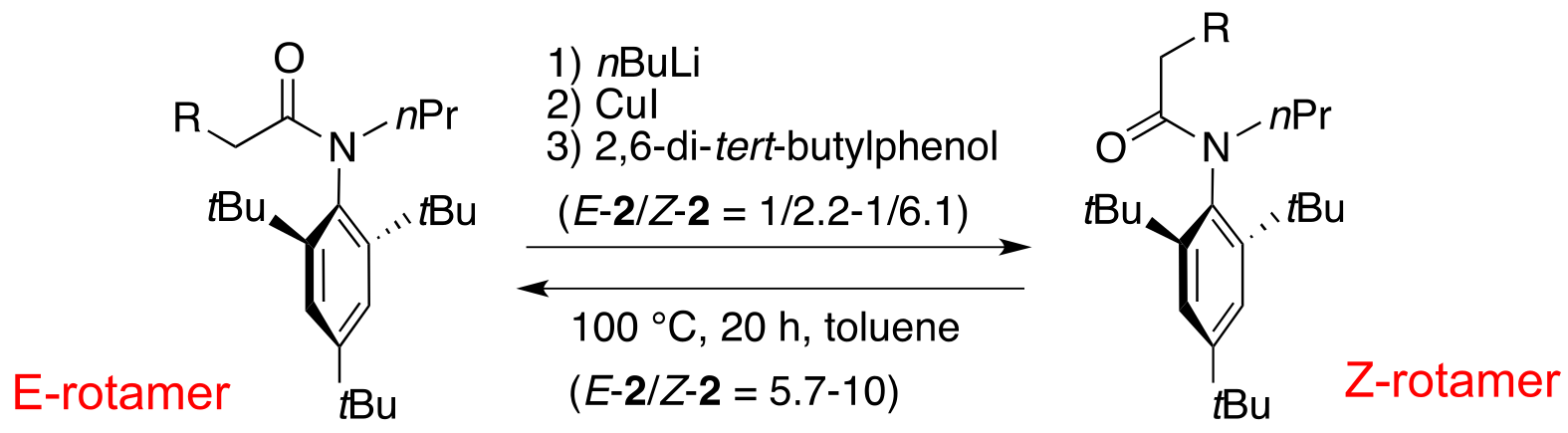
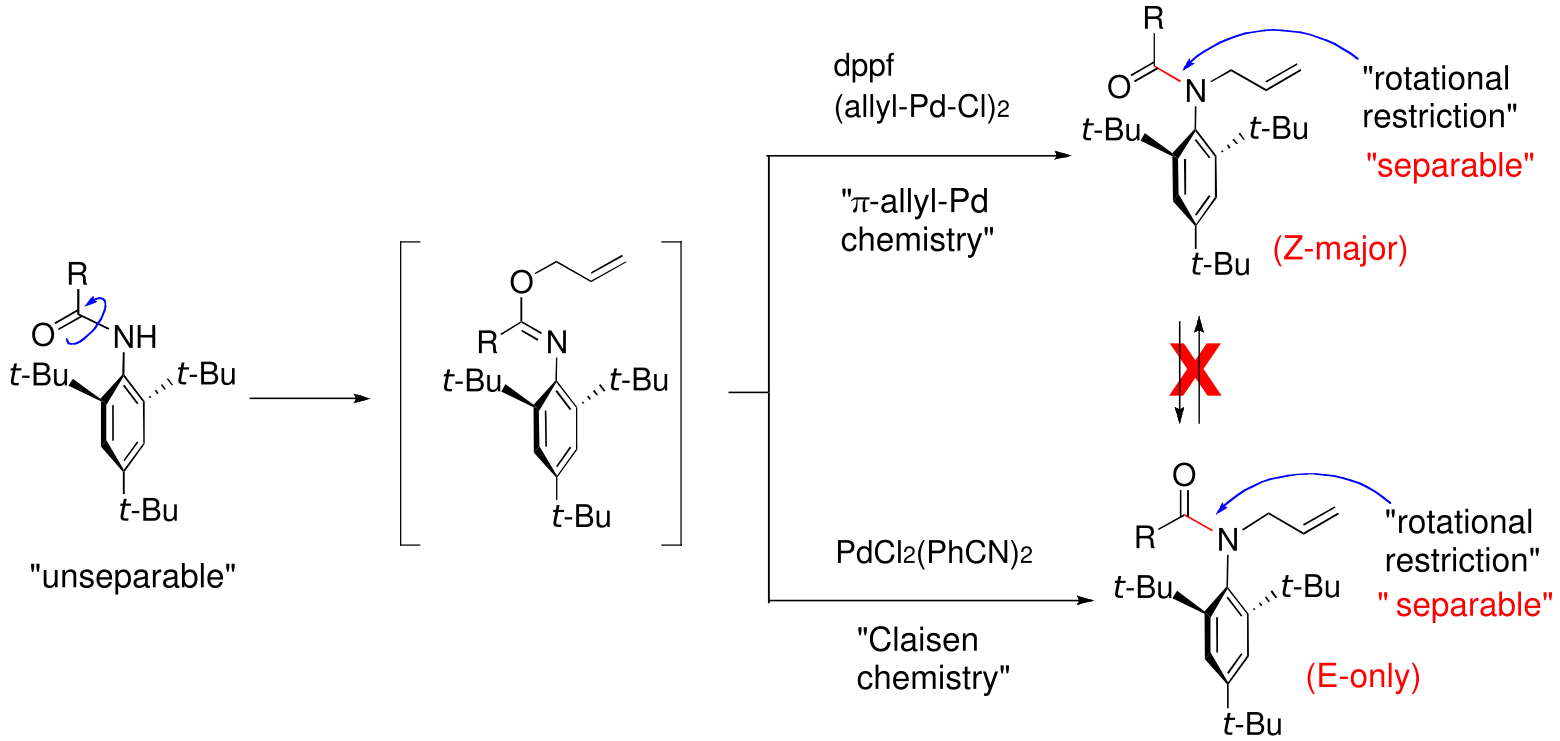
アミドのC(O)-N結合は,その二重結合性のためアミンのC-N結合に比べ回転障壁が高く,NMR等でその配座異性体がしばしば観察される.ただし,常温で単離できるほど安定ではなく,アミドの配座異性体が分離された例は極めて少ない.2,6-di-tert-ブチルアニリド誘導体は,アミドの配座異性体が分離可能な数少ない分子であるが,その立体選択的な合成法や構造化学的詳細は知られていなかった.我々は,Pdケミストリーを利用して2,6-di-tert-ブチルアニリド誘導体の配座異性体(E-体とZ-体)をそれぞれ高選択的に合成すること(立体分岐合成)に成功した.本反応は,過去に報告例のない新しいタイプの立体選択的反応である.
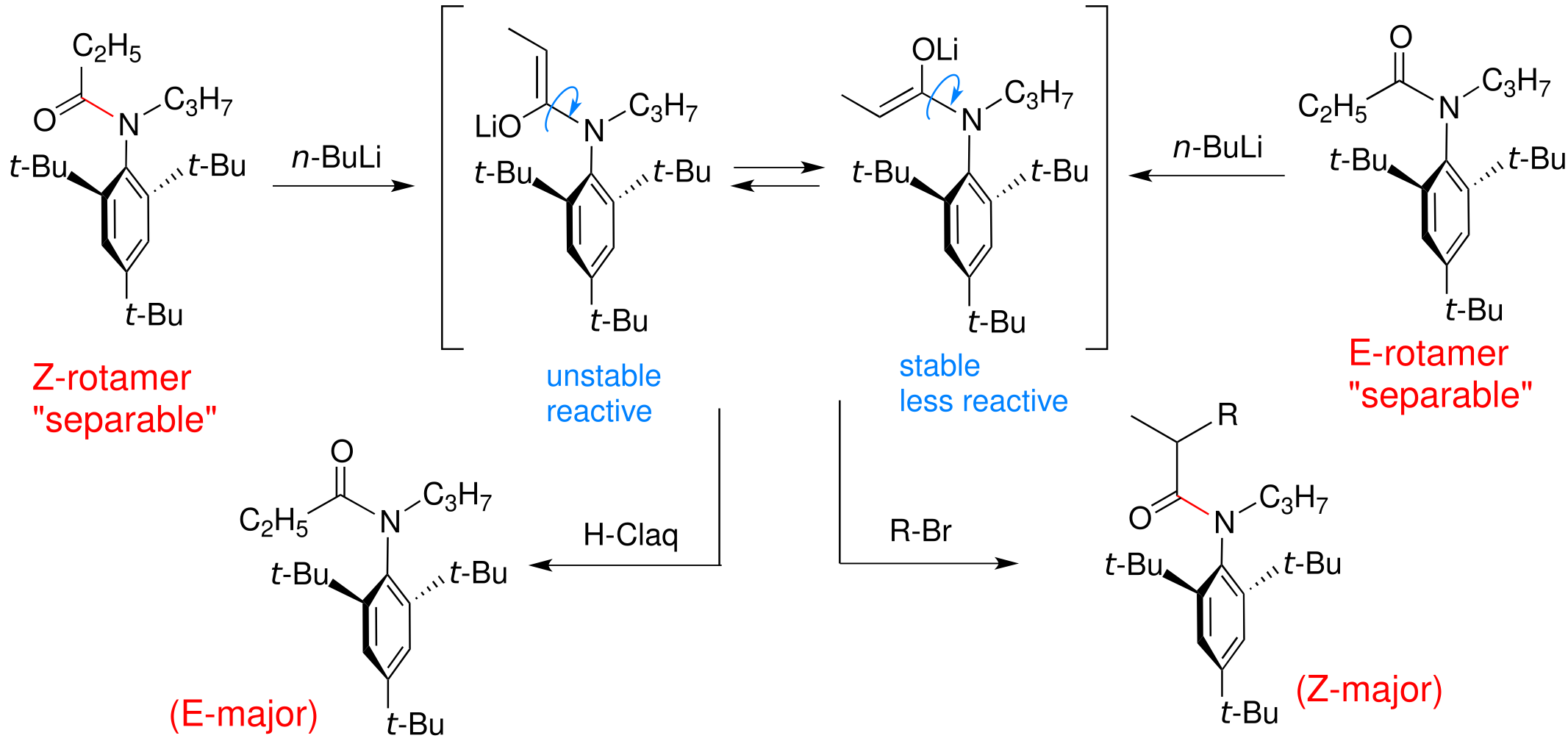
さらに,このようにして高選択的に合成したアニリド配座異性体の興味ある構造特性も見いだした.すなわち,アニリドから調製したリチウムエノラートは,室温でも配座異性体間の相互変換が容易に生じている.このエノラートに対して親電子剤を加えると,その反応性に応じて生成物の配座異性体比が劇的に変化する.例えば,親電子剤として塩酸(高反応性親電子剤)を加えると,E-配座異性体が優先的に生成し,臭化アルキル(低反応性親電子剤)を加えるとZ−配座のα−アルキル化生成物が主配座異性体として得られた.この結果は,アニリドエノラートが親電子剤の反応性を認識し,その反応性に応じて柔軟に配座を変化させて生成物を与えることを示している.このように,アニリドの配座的剛直性に加え,アニリドエノラートの配座的柔軟性という二面性を明らかにした.
このアニリドエノラートの配座的柔軟性を利用することにより,アニリド配座異性体間の可逆的構造変換に成功した.すなわち,アニリドより調製した銅エノラートに対し,2,6-di-tert-butylphenolを用いてプロトン化すると,Z-体を主とする配座異性混合物が得られる(E/Z = 1/2.2-1/6.1).一方,このZ-体を主とする配座異性混合物をトルエン中加熱すると,E-体を主とする配座異性混合物を与えた(E/Z = 5.7-10).